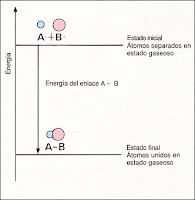
Energía de enlace A-B: energía necesaria para romper un mol
de enlaces A-B o la que se desprende al formarse el mismo número de enlaces
A-B. Se acostumbra a dar en kJ/mol.
Longitud de enlace: distancia entre los núcleos de los dos átomos que están
formando el enlace.
Polaridad de un enlace covalente: Para entender este
concepto debemos comenzar por recordar que la electronegatividad es la medida
de la atracción que ejerce un átomo sobre los electrones que comparte con
otros. Dependiendo de la electronegatividad de los átomos, los enlaces
covalentes pueden ser:
- Apolares: Si los dos átomos tienen la misma electronegatividad y por tanto la distribución de carga electrónica entre los núcleos es totalmente simétrica.
- Polares: Si los dos átomos tienen distinta electronegatividad. En este caso, uno de ellos atrae más los electrones del enlace que el otro, estableciéndose una separación de cargas o lo que es igual, la distribución de carga electrónica entre los núcleos será asimétrica.
Pero un enlace polar no requiere siempre una molécula polar; para averiguar si una molécula es polar hay que atender a la cantidad de enlaces polares y la estructura de la molécula. Para ello es necesario determinar un parámetro físico llamado momento dipolar eléctrico del dipolo eléctrico (p). Se define como una magnitud vectorial con módulo igual al producto de la carga q por la distancia que las separa L, cuya dirección va de la carga negativa a la positiva.
Dipolos:
La polaridad es la suma vectorial de los momentos
dipolares de los enlaces, y viendo si la suma vectorial es nula o no
observaremos su carácter polar o apolar.
De esta manera una molécula que solo contiene enlaces
apolares es siempre apolar, ya que los momentos dipolares de sus enlaces son
nulos. En moléculas diatómicas son apolares las moléculas formadas por un solo
elemento o elementos con diferencia de electronegatividad muy reducida.
Serán también apolares las moléculas simétricas:
El agua, por ejemplo, es una molécula fuertemente polar ya que los
momentos dipolares de los enlaces dispuestos en "V" se suman
ofreciendo una densidad de carga negativa en el oxígeno y dejando los
hidrógenos casi sin electrones.
El enlace iónico sería una extrapolación del enlace covalente polar en el que la diferencia de electronegatividad es tan grande que uno de los dos átomos se ha quedado con los electrones que el otro le ha cedido.