Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben vencer para que se produzca un cambio químico. Son estas fuerzas, por tanto, las que determinan las propiedades químicas de las sustancias.
Sin embargo existen otras fuerzas intermoleculares que actúan sobre distintas moléculas o iones y que hacen que éstos se atraigan o se repelan. Estas fuerzas son las que determinan las propiedades físicas de las sustancias como, por ejemplo, el estado de agregación, el punto de fusión y de ebullición, la solubilidad, la tensión superficial, la densidad, etc.
Por lo general son fuerzas débiles pero, al ser muy numerosas, su contribución es importante. La figura inferior resume los diversos tipos de fuerzas intermoleculares.
Fuerzas de Van der Waals
Las fuerzas de van der Waals son fuerzas de estabilización
molecular (dan estabilidad a la unión entre varias moléculas), también
conocidas como atracciones intermoleculares o de largo alcance y son las
fuerzas entre moléculas (fuerzas entre molécula-molécula).
Son mas débiles que
las internas en una molécula ya que dependen exclusivamente del tamaño y forma
de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no
se las puede considerar un enlace, como los enlaces covalente, metálico o iónico, solo se
las considera una atracción. Para tener una idea de la poca fuerza que tienen,
si un enlace covalente tuviera una fuerza de 100, las de van der Waals serían
de valor 1 (100 veces menor).
Sabiendo que existen moléculas polares y no polares, explicaremos
los 3 tipos de fuerzas diferentes de van der Waals que pueden darse entre
moléculas.
- Fuerza entre dos dipolos permanentes (interacción dipolo-dipolo o fuerzas de Keesom).
- Fuerza entre un dipolo permanente y un dipolo inducido (fuerzas de Debye).
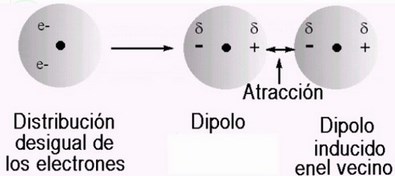
- Fuerza entre dos dipolos inducidos instantáneamente (fuerzas de dispersión de London).
Enlace de Hidrogeno:
Es una interacción primordialmente de tipo dipolo–dipolo especialmente fuerte, que se da entre un átomo de hidrógeno con carga parcial positiva y un átomo electronegativo pequeño (normalmente N, O o F).

La presencia de enlace de hidrogeno en el H2O, NH3 y HF, justifica sus anormales puntos de fusión y ebullición (ver figura). Es también el responsable de la alta capacidad calorífica molar del agua líquida, así como de sus elevados calores de vaporización y de fusión.
Los puentes de hidrógeno aparecen en el ADN, el agua y las
proteínas, por ejemplo. Debido a su existencia, se producen fenómenos de gran
importancia, que incluso aparecen de manera cotidiana. El punto de ebullición
del agua, la menor densidad del hielo respecto al agua líquida y la consistencia
de la glicerina están vinculados a la presencia de puentes de hidrógeno en las
moléculas.


