Mostrando entradas con la etiqueta Enlace Químico. Mostrar todas las entradas
Mostrando entradas con la etiqueta Enlace Químico. Mostrar todas las entradas
Iónico y metálico
Enlace iónico
El enlace iónico se produce por transferencia de electrones entre un metal, capaz de ceder electrones, y un no metal, capaz de captarlos. Es decir, entre átomos con electronegatividades muy diferentes. Las fuerzas de atracción electrostática entre iones de diferente signo dan lugar al enlace iónico. Se denomina electrovalencia o valencia iónica al número de electrones intercambiados por cada elemento en un enlace iónico.
RED IÓNICA: Cuando los átomos se unen por unión iónica forman compuestos
no moleculares llamados celdas iónicas,
estructuras formadas por cationes y aniones unidos de tal manera que forman una
estructura tridimensional o red característica.
Enlace metálico
El enlace metálico se produce cuando se unen átomos de un mismo metal, produciéndose estructuras muy compactas formando redes tridimensionales. Las sustancias metálicas tienen propiedades muy características, como el brillo y la conductividad eléctrica, de aquí se deduce que los electrones implicados en este tipo de enlace deben tener gran libertad de movimiento.
RED METÁLICA: Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compacta
1 entrada
Enlace Químico
Cadenas carbonadas
Una cadena carbonada es el esqueleto de la práctica
totalidad de los compuestos orgánicos y está formada por un conjunto de varios
átomos de carbono, unidos entre sí mediante enlaces covalentes carbono-carbono
y a la que se unen o agregan otros átomos como hidrógeno, oxígeno o nitrógeno,
formando variadas estructuras, lo que origina infinidad de compuestos
diferentes.
La facilidad del carbono para formar largas cadenas es casi
específica de este elemento y es la razón del elevado número de compuestos de
carbono conocidos, si lo comparamos con compuestos de otros átomos.
El átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
1 entrada
Enlace Químico
Teoría de Hibridación
La teoría de hibridación de orbitales, establecida por Linus
Pauling en su obra publicada en 1931 The Nature of the Chemical Bond,
complementa la teoría de enlace de valencia a la hora de explicar la formación
de enlaces covalentes. En concreto, la hibridación es el mecanismo que
justifica la distribución espacial de los pares de electrones de valencia
(lineales, triangulares planas y tetraédricas). Los tipos de hibridación de
orbitales que necesitamos aplicar para justificar la geometría de las moléculas
más simples son: sp, sp2 y sp3.
Las ideas básicas que permiten una primera aproximación al
modelo de hibridación son:
- Un orbital híbrido es una combinación de orbitales atómicos
- El número de orbitales híbridos que se forman es igual al número de orbitales atómicos que se combinan.
- Los orbitales híbridos formados tienen la misma forma y una determinada orientación espacial: sp lineal; sp2 triangular plana y sp3 tetraédrica.
- Los orbitales híbridos disponen de una zona o lóbulo enlazante y otra zona o lóbulo antienlazante; el enlace se produce por el solapamiento del lóbulo enlazante con el otro orbital del átomo a enlazar.
1 entrada
Enlace Químico
Parámetros del enlace covalente
Energía de enlace A-B: energía necesaria para romper un mol
de enlaces A-B o la que se desprende al formarse el mismo número de enlaces
A-B. Se acostumbra a dar en kJ/mol.
Longitud de enlace: distancia entre los núcleos de los dos átomos que están
formando el enlace.
Polaridad de un enlace covalente: Para entender este
concepto debemos comenzar por recordar que la electronegatividad es la medida
de la atracción que ejerce un átomo sobre los electrones que comparte con
otros. Dependiendo de la electronegatividad de los átomos, los enlaces
covalentes pueden ser:
- Apolares: Si los dos átomos tienen la misma electronegatividad y por tanto la distribución de carga electrónica entre los núcleos es totalmente simétrica.
- Polares: Si los dos átomos tienen distinta electronegatividad. En este caso, uno de ellos atrae más los electrones del enlace que el otro, estableciéndose una separación de cargas o lo que es igual, la distribución de carga electrónica entre los núcleos será asimétrica.
Pero un enlace polar no requiere siempre una molécula polar; para averiguar si una molécula es polar hay que atender a la cantidad de enlaces polares y la estructura de la molécula. Para ello es necesario determinar un parámetro físico llamado momento dipolar eléctrico del dipolo eléctrico (p). Se define como una magnitud vectorial con módulo igual al producto de la carga q por la distancia que las separa L, cuya dirección va de la carga negativa a la positiva.
Dipolos:
La polaridad es la suma vectorial de los momentos
dipolares de los enlaces, y viendo si la suma vectorial es nula o no
observaremos su carácter polar o apolar.
De esta manera una molécula que solo contiene enlaces
apolares es siempre apolar, ya que los momentos dipolares de sus enlaces son
nulos. En moléculas diatómicas son apolares las moléculas formadas por un solo
elemento o elementos con diferencia de electronegatividad muy reducida.
Serán también apolares las moléculas simétricas:
El agua, por ejemplo, es una molécula fuertemente polar ya que los
momentos dipolares de los enlaces dispuestos en "V" se suman
ofreciendo una densidad de carga negativa en el oxígeno y dejando los
hidrógenos casi sin electrones.
El enlace iónico sería una extrapolación del enlace covalente polar en el que la diferencia de electronegatividad es tan grande que uno de los dos átomos se ha quedado con los electrones que el otro le ha cedido.
1 entrada
Enlace Químico
Teoría de enlace de valencia
La formación del enlace covalente simple tiene lugar cuando
los orbitales correspondientes a dos electrones desapareados de átomos
diferentes se superponen o solapan, dando lugar a una región común en la cual
los dos electrones con espines opuestos, tal y como exige el principio de
exclusión de Pauli, ocupan un mismo orbital. Ese par compartido constituye el
elemento de enlace entre los dos átomos.
Si los orbitales que se solapan son s y/o p, se pueden
considerar dos tipos de enlace:
- Enlace sigma. Cuando el solapamiento es frontal.
- Enlace pi. Cuando el solapamiento es lateral. Se produce entre orbitales p.
Así, por ejemplo, cuando dos átomos de H se aproximan
suficientemente, existe una disposición en la cual sus nubes electrónicas están
parcialmente solapadas y para la que la energía potencial del conjunto es
mínima, constituyendo, pues, una situación de enlace. En términos electrónicos
puede afirmarse que el orbital 1s de cada átomo de hidrógeno, semiocupado por
su electrón correspondiente, es completado por el electrón del otro átomo de
hidrógeno. Los dos electrones con espines opuestos de este par, son atraídos
entonces por cada uno de los núcleos, constituyendo el par de enlace. La
existencia de este par común es lo que determina que los núcleos estén ligados
entre sí con las limitaciones que, en cuanto a proximidad, imponen las fuerzas
de repulsión nuclear.
La primitiva idea de comparación de electrones de Lewis
sigue, de algún modo, presente en la teoría del enlace de valencia, aunque se
abandona la regla del octeto y se sustituye por la condición de que dos
electrones desapareados puedan ocupar un mismo orbital. El número de enlaces
covalentes posible depende, entonces, del número de electrones desapareados
presentes en el átomo correspondiente o en algún estado excitado previo a la
formación de la molécula.
En algunos casos, esta teoría supone que electrones que
estaban apareados tienen que desaparearse, así se explican las valencias
anómalas de algunos átomos por desapareamiento de electrones que pasan a ocupar
orbitales vacíos del mismo nivel electrónico.
Por ejemplo, el cloro: Cl (Z= 17) 1s2 2s2 2p6 3s2 3p5
Covalencias: 1, 3, 5 y 7
1 entrada
Enlace Químico
Enlace covalente coordinado o dativo
El enlace de coordinación, igual conocido como enlace
covalente dativo o enlace dipolar, es un enlace coordinado en el que cada par
de electrones compartido por dos átomos es aportado por uno de ellos. El átomo
que aporta el par de electrones se denomina dador, y el que lo recibe,
receptor.
Ejemplo: Ion Hidronio (también oxonio)
Ejemplo: Ion Amonio
1 entrada
Enlace Químico
Estructuras de Lewis
Electrones de valencia: son los electrones que se
encuentran en los mayores niveles de energía del átomo, siendo estos los
responsables de la interacción entre átomos de distintas especies o entre los
átomos de una misma. Los electrones en los niveles de energía externos son
aquellos que serán utilizados en la formación de compuestos y a los cuales se
les denomina como electrones de valencia.
Estructura de Lewis, también llamada diagrama de punto,
modelo de Lewis o representación de Lewis, es una representación gráfica que
muestra los enlaces entre los átomos de una molécula y los pares de electrones
solitarios que puedan existir.
Esta representación se usa para saber la cantidad de
electrones de valencia de un elemento que interactúan con otros o entre su
misma especie, formando enlaces ya sea simples, dobles, o triples y estos se
encuentran íntimamente en relación con los enlaces químicos entre las moléculas
y su geometría molecular, y la distancia que hay entre cada enlace formado.
1 entrada
Enlace Químico
Enlace químico y estabilidad energética
ENLACE QUÍMICO
De todos los elementos del sistema periódico, los únicos que pueden encontrarse aislados en la naturaleza, son combinarse con ellos mismos o con otros átomos, son los gases nobles. El resto tiende a unirse mediante una serie de fuerzas con el fin de adquirir mayor estabilidad.
Las fuerzas que mantienen unidos los átomos se denominan enlaces. Un enlace químico se produce cuando los átomos unidos adquieren un estado de menor energía y por tanto de mayor estabilidad, que cuando estaban aislados.
Cuando dos átomos están lo suficientemente separados, se puede suponer que no existe influencia mutua entre ellos y que la energía del sistema formado es nula. A medida que se van acercando, se ponen de manifiesto una serie de fuerzas de atracción de sus núcleos sobre las nubes electrónicas de los otros átomos (fuerzas de largo alcance), lo que produce una disminución de la energía del sistema.
Cuando los átomos se encuentran uno cerca del otro, empiezan a actuar las fuerzas de repulsión entre las nubes electrónicas, estas fuerzas tienen un efecto mayor a corta distancia, entonces el sistema se desestabiliza.
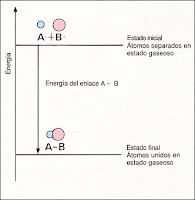
Estas situaciones se pueden representar gráficamente mediante curvas de estabilidad. Se observa que existe una distancia internuclear en la que el sistema es más estable, siendo máximas las fuerzas de atracción y mínimas las de repulsión. Se denomina distancia de enlace. La energía correspondiente a esta distancia es la que se desprende al formarse dicho enlace.
Enlace covalente
El enlace covalente se produce por compartición de electrones entre elementos no metálicos o con el hidrógeno, entre átomos de electronegatividades semejante. Se llama covalencia o valencia covalente al número de electrones compartidos por cada elemento en un compuesto covalente, que coincide con el número de electrones desapareados del átomo.
Enlace iónico
El enlace iónico se produce por transferencia de electrones entre un metal, capaz de ceder electrones, y un no metal, capaz de captarlos. Es decir, entre átomos con electronegatividades muy diferentes. Las fuerzas de atracción electrostática entre iones de diferente signo dan lugar al enlace iónico. Se denomina electrovalencia o valencia iónica al número de electrones intercambiados por cada elemento en un enlace iónico.
Enlace metálico
El enlace metálico se produce cuando se unen átomos de un mismo metal, produciéndose estructuras muy compactas formando redes tridimensionales. Las sustancias metálicas tienen propiedades muy características, como el brillo y la conductividad eléctrica, de aquí se deduce que los electrones implicados en este tipo de enlace deben tener gran libertad de movimiento.
Enlaces intermoleculares
Los enlaces intermoleculares se dan entre moléculas, básicamente consisten en interacciones dipolo-dipolo, debidas a la polaridad de las moléculas.
1 entrada
Enlace Químico
Covalencia, valencia iónica y número de oxidación
Covalencia o Valencia covalente: Nº de electrones sin aparear que un átomo posee o puede poseer. En cada caso concreto la covalencia es el número de electrones de un átomo que forman enlace.
Valencia iónica: Nº de electrones ganados o perdidos al formar un enlace iónico.
Número de oxidación (n.o.) de un átomo en un compuesto es el número teórico (formal) que se obtiene aplicando unas reglas sencillas y que nos informan sobre la carga que presentaría dicho átomo, si los pares electrónicos que forman los enlaces se asignaran a los átomos más electronegativos. El número de oxidación es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado. El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
1 entrada
Enlace Químico
Suscribirse a:
Entradas (Atom)































.png)










