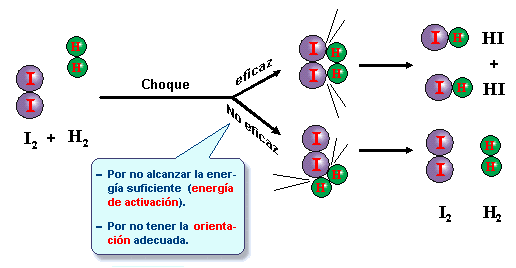
Puesto que en una reacción química tiene lugar la ruptura de
enlaces entre los átomos de las moléculas de los reactivos y la formación de
nuevos enlaces para originar las moléculas de los productos, es necesario que
las moléculas reaccionantes entren en contacto, “choquen”, por lo que a mayor
número de choques, mayor velocidad de reacción. Ahora bien, no todos los
choques son eficaces (se rompen los enlaces), para esto se requiere:
- Las moléculas han de tener suficiente energía cinética para que al chocar, los enlaces se rompan o se debiliten. Esta mínima Ec se llama Energía de activación, y las moléculas que la poseen se llaman moléculas activadas.
- El choque tiene que producirse en la dirección adecuada.
a) choque eficaz
b) choque no eficaz
TEORÍA DEL COMPLEJO ACTIVADO
El complejo de transición (complejo activado) es un agregado constituido por las moléculas reaccionantes, y en el que algunos de los enlaces primitivos se han debilitado (o incluso roto) y se han empezado a formar nuevos enlaces. Como tiene acumulada toda la energía de las moléculas reaccionantes, es muy inestable, y se descompone inmediatamente originando los productos de la reacción.
Complejo activado que se produce en la formación del agua:
2H2 + O2 ® H2O
ENERGÍA DE ACTIVACIÓN
La Energía de activación representa una barrera energética: si la Ea es pequeña habrá muchas moléculas con Ec mayor que la Ea, por lo que habrá muchos choques eficaces y la velocidad de reacción será grande, pero si la Ea es elevada, habrá pocas moléculas que puedan remontar la barrera, por lo que casi todos los choques serán ineficaces y la velocidad de reacción será pequeña.